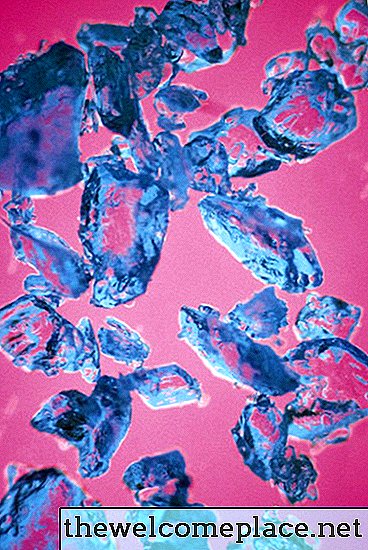
Birçok geçiş metali kompleksi gibi, bakır (II) sülfat pentahidrat parlak renklidir; bu güzel maddenin kristalleri soluk mavinin gölgesidir. Rengi, bileşiminin kimyası ve fiziğinden (ya da daha spesifik olarak, bakıra bağlı sülfat iyonları ve su molekülleri ile oluşturduğu bağlar) türünden kaynaklanır.
 Bakır sülfat pentahidrat, güzel bir yarı saydam mavi renge sahiptir.
Bakır sülfat pentahidrat, güzel bir yarı saydam mavi renge sahiptir.Orbitalleri
Elektronlar hem dalga benzeri özelliklere hem de parçacık benzeri özelliklere sahip oldukları için dalga parçacık çiftliği sergilerler. Bir elektronun bir atomdaki davranışı, dalga işlevi adı verilen dalga benzeri bir denklem ile tanımlanır. Dalga fonksiyonunun karesi, elektronun herhangi bir zamanda herhangi bir belirli noktada bulunma olasılığını verir. Elektronların atomlardaki dalga fonksiyonlarına atomik orbitaller de denir. Kimyacılar, orbitalin enerji seviyesini belirlemek için bir sayı kullanarak atomik orbitalleri, ardından orbitalin tipini belirten bir harf kullanarak adlandırırlar. Periyodik tablonun dördüncü periyodundaki veya daha üstündeki elementler için, sadece s, p ve d olmak üzere üç tür yörüngeye odaklanmanız gerekir. Bu yörüngelerin şekli hakkında bir fikir edinmek için kaynaklar bölümündeki bağlantıya bakın.
Kristal alan yarma
Bakır (II) sülfattaki bakır iyonu iki elektron kaybetti, bu nedenle +2 yükü var. En dış enerji seviyesinde veya kabuğunda dokuz elektron vardır; bu sözde değerlik elektronlarının tümü 3B yörüngeyi işgal eder. Su molekülleri ve sülfat iyonları, bakır iyonundaki pozitif yüke çekilir, bu yüzden yaklaşırlar ve etrafını oktahedral bir konfigürasyonda düzenlerler. Sonuç olarak, bakır iyonunun beş 3d yörüngesinden ikisi, sülfat iyonlarının ve su moleküllerinin yaklaştığı eksenler boyunca hizalanır; Bu yörüngelerdeki elektronlar ve molekül / iyonlardaki elektronların her ikisi de negatif yüke sahip olduklarından, birbirlerini iterler. Sonuçta, o zaman, beş 3B yörüngeden ikisi enerjiyi arttırmıştır; bunlara örneğin orbitaller denir. Diğer üçte ise aksine, enerji azalmıştır ve t2g orbitalleri denir.
Işık absorpsiyonu
Bir elektronun halihazırda işgal ettiği durum ile mevcut başka bir durumun enerjisi arasındaki farka eşdeğer bir enerjiye sahip olması durumunda, bir ışık fotonu koordinasyon kompleksi tarafından emilecektir. Sonuç olarak, bakır sülfat kompleksi, t2g ve örneğin orbitaller arasındaki enerji farkına eşdeğer enerjilere sahip ışık fotonlarını emebilir. Olduğu gibi, bakır sülfat kompleksi için enerji farkı, spektrumun kırmızı-turuncu bölgesinde ışık fotonları için enerji farkı ile aynıdır. Mavi ışık iletilirken kırmızımsı ışık absorbe edildiğinden, bakır sülfat mavi görünür.
Suda Çözünme
Bakır sülfat suda çözündüğünde, bakır ve sülfat iyonları ayrışır. Şimdi bakır iyonu altı molekül su ile çevrili bir oktahedral kompleks oluşturuyor. Ancak bu etki hala aynıdır, çünkü bu yeni kompleks içindeki t2g orbitalleri ile örneğin orbitalleri arasındaki bölünme hala kırmızımsı-turuncu ışığın emileceği ve mavi renkli bir çözelti görecek şekildedir.